Taurolidin: Von der Entdeckung bis heute
Erforschung des Namensgebers von TauroLock™
Alle unsere Locklösungen haben eines gemeinsam: Den aktiven Wirkstoff Taurolidin. Diese Substanz hat in den letzten Jahrzehnten für viel Gesprächsstoff gesorgt. Wissenschaftler haben sie in verschiedenen Kontexten suggestiv als „neue Waffe" [1] und sogar als „Silberkugel" [2] bezeichnet. Was macht Taurolidin in den Augen vieler Experten so wirksam? Woher kommt es, wie wird es heute eingesetzt, und haben wir überhaupt schon sein volles Potenzial ausgeschöpft? Dieser Artikel beleuchtet die Wissenschaft hinter dem Wirkstoff, der die Grundlage für TauroPharm und seine Produkte bildet.
Inhalte
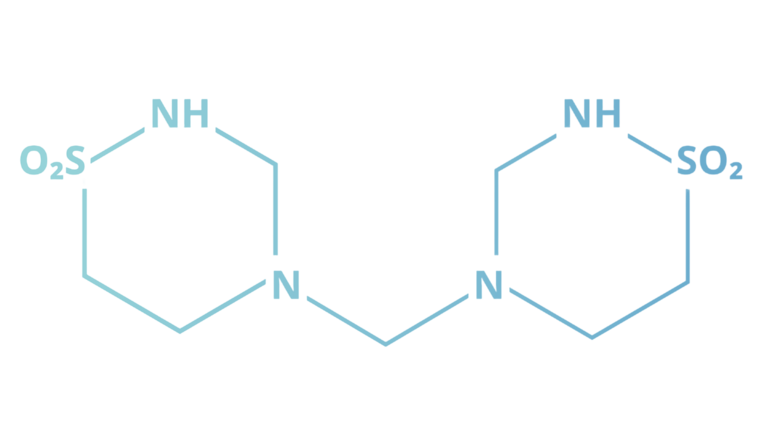
Chemisch gesehen ist Taurolidin ein kleines dimeres Molekül, das von der Aminosäure Taurin abgeleitet wird. [3] Taurin kommt natürlicherweise im menschlichen Körper vor und ist auch in vielen Energydrinks enthalten. (Laut einer Studie aus dem Jahr 2023 könnte es sogar Anti-Aging-Eigenschaften haben!) [4]
In den 1970er Jahren begann das Schweizer Unternehmen Geistlich-Pharma mit der Herstellung von Taurolidin als neue chemische Substanz. Im Jahr 1985 veröffentlichten Browne et al. eine Übersichtstudie, in der die Forschungsergebnisse über das neuartige antimikrobielle Mittel zusammengefasst wurden. Mit Blick auf die chirurgische Sepsis stellten die Autoren fest, dass „wir jetzt nach einer neuen Waffe suchen müssen, die alle Keime vernichtet" und dass Taurolidin „diesen Bedarf decken könnte". [1] Ihre Einschätzung stützte sich auf frühere In-vitro-Studien, die „extrem empfindliche" Reaktionen von Mikroorganismen auf Taurolidin gezeigt hatten, ohne „Hinweise auf systemische Toxizität". [1] Taurolidin wurde auch in klinischen Studien („in vivo") zur Behandlung von Bauchfellentzündungen getestet und führte zu „statistisch signifikanten" Verbesserungen ohne Komplikationen. [1] Es dauerte ein weiteres Jahrzehnt, bis diese frühen Ergebnisse durch weitere Studien ergänzt wurden. Zu Beginn des 21. Jahrhunderts nahm der Diskurs um Taurolidin und seine antimikrobielle Wirksamkeit schließlich Fahrt auf.
Anti-Tumor-Wirksamkeit
In mehreren früheren Veröffentlichungen wurde Taurolidin aufgrund seiner Wirkung auf Krebszellen als „Chemotherapeutikum" [1,5] bezeichnet. In einer Studie aus dem Jahr 2000 wurde festgestellt, dass die Exposition gegenüber Taurolidin das Wachstum von Tumorzellen sowohl in vitro als auch in vivo (bei Tierversuchen) erheblich hemmen kann. Weitere Studien bestätigten, dass es dieselbe Wirkung auf menschliche Tumorzellen hat. [5,6]. Die antineoplastische (d. h. krebshemmende) Wirkung von Taurolidin erwies sich als stark genug, um „die Apoptose zu verstärken, die Angiogenese zu hemmen, die Tumoranhaftung zu verringern, die Freisetzung proinflammatorischer Zytokine herunter zu regulieren und die Immunregulation gegen Krebs nach einem chirurgischen Trauma zu stimulieren". [3]
Immunoregulation
Die Entdeckung der Anti-Tumor-Wirkung von Taurolidin ging Hand in Hand mit der Erforschung seiner Auswirkungen auf das Immunsystem. Während es der Vermehrung von Krebszellen entgegenwirkt, blockiert es auch die Synthese der Proteine IL-10 und TNF. [7] Diese Proteine wirken als Entzündungsmarker: Wenn sie in erhöhter Konzentration im Körper vorkommen, signalisieren sie, dass das Immunsystem gerade eine Infektion abwehrt. Niedrigere Werte dieser Proteine weisen wiederum auf ein verbessertes Entzündungsprofil hin. [8] Die Wissenschaftler kamen daher zu dem Schluss, dass Taurolidin „ein wirksamer immunmodulatorischer Wirkstoff in einem klinischen Umfeld" sein könnte. [9]

Antibiofilm-Wirksamkeit
Die Erkenntnisse über die tumorhemmenden und immunregulierenden Eigenschaften von Taurolidin haben ein weiteres Forschungsfeld eröffnet: Seine Wirkung auf den sogenannten Biofilm. Allgemein versteht man unter „Biofilm“ eine dünne Schicht von Mikroorganismen, die auf vielen nassen Oberflächen wächst. Dies bietet einen idealen Nährboden für Keime und stellt daher im klinischen Kontext eine ernsthafte Bedrohung dar. Oftmals ist die Bildung von Biofilm der erste Schritt zur Entwicklung einer Infektion. Er erleichtert es Mikroorganismen nicht nur, sich anzusammeln und zu vermehren, sondern macht sie auch widerstandsfähiger. Bald nachdem sie sich angesiedelt haben, gehen viele Mikroorganismen in eine Art Ruhezustand über, der als „Dormanz" bezeichnet wird. Sie stellen ihr Wachstum ein und reagieren weniger empfindlich auf Angriffe des Immunsystems oder die Einnahme von Antibiotika. [10] Daher sind ruhende oder „reife" Krankheitserreger für infektionsgefährdete Patienten besonders gefährlich.
Taurolidin hat sich als effektives Mittel zur Bekämpfung dieser Bedrohung erwiesen. In den letzten 25 Jahren haben zahlreiche Studien gezeigt, wie es Biofilm nicht nur vorbeugt, sondern sogar beseitigt. [11,12,13,14]. Taurolidin zeigt eine starke antimikrobielle Aktivität gegen ein breites Spektrum von Bakterien und Pilzen – und zwar insbesondere gegen solche, die bekanntermaßen häufig Infektionen verursachen. Dazu gehören u. a. Vancomycin-resistente Enterokokken (VRE), Methicillin-resistenter S. aureus (MRSA) und Candida albicans. [14] Wissenschaftler fanden auch heraus, dass Taurolidin reifere Biofilme in Stadien inaktivieren kann, in denen andere antimikrobielle Mittel unwirksam werden. [15]

Nachdem zahlreiche Studien die antimikrobiellen Eigenschaften von Taurolidin untersucht (und bestätigt) hatten, stellte sich die nächste Frage: Wo und wie könnten diese Eigenschaften genutzt werden? Gegen Ende des 20.. Jahrhunderts begannen Forschende zunehmend, mögliche Anwendungen in verschiedenen medizinischen Bereichen zu untersuchen. Das Hauptziel ist bis heute dasselbe: Die wirksame Behandlung und vor allem die Prävention von Infektionen.
Taurolidine zur Behandlung von Infektionen
Klinische Nachweise für Taurolidin bei der Behandlung von Peritonitis (d. h. Entzündungen und Infektionen in der Bauchhöhle) wurden erstmals Mitte der 1980er Jahre veröffentlicht. In zwei randomisierten Studien wurde festgestellt, dass die antimikrobielle Wirkung von Taurolidin den Heilungsprozess begünstigt und das Risiko von Komplikationen verringert. [17,18,19] Dies wurde durch mehrere Veröffentlichungen in den 1990er Jahren weiter untermauert. [19,20,21]
Erst kürzlich wurde in einem Fallbericht aus dem Iran Taurolidin als „vielversprechende therapeutische Option für schwierige Wundinfektionen" bezeichnet. [22] Die Studiengruppe kam zu diesem Schluss, nachdem sie einen 17-jährigen Patienten mit einem Ulkus im Stadium III erfolgreich behandelt hatte. Antibiotika, regelmäßiges Debridement und Verbandswechsel halfen nicht. Daraufhin wurde der Ulkus mit einer Taurolidin-Lösung gespült. Dies führte zu einer progressiven Wundgranulation und vollständigen Reepithelisierung nach 2 Monaten. Nach einem Jahr war die Wunde vollständig abgeheilt, ohne dass es zu unerwünschten Ereignissen gekommen war.
Alles in allem hat Taurolidin großes Potenzial als therapeutisches Mittel gezeigt. Dieses Potenzial muss jedoch erst noch in der medizinischen Praxis umgesetzt und standardisiert werden. Die Forschung zur Behandlung von Bauchfellentzündungen hat gleichwohl den Weg für ein weiteres Anwendungsgebiet geebnet: Locklösungen für zentralvenöse Katheter.
Taurolidin in Locklösungen
Bakterien, die eine Bauchfellentzündung verursachen (z. B. Pseudomonas aeruginosa oder Staphylococcus aureus) [23], kommen auch häufig in Biofilmen in zentralvenösen Zugangssystemen („central-venous access devices“, kurz CVAD) vor. Es war daher nur eine Frage der Zeit, bis Wissenschaftler begannen, das Potenzial von Taurolidin als Locklösung zu erforschen.
CVADs (d. h. Katheter und Ports) werden in verschiedenen Zusammenhängen eingesetzt:
- Bei der Dialyse dienen sie als das Gefäß, wodurch das Blut des Patienten aus dem Körper heraus- und in den Körper zurückfließt.
- In der Onkologie werden sie bei Patienten implantiert, die über mehrere Monate (oder sogar Jahre) eine Chemotherapie erhalten.
- In der parenteralen Ernährung versorgen sie Patienten, die unter chronischem Darmversagen leiden, mit Nährstoffen.
Zentralvenöse Katheter sind „lifelines“ im wahrsten Sinne des Wortes: Die Patienten sind auf sie angewiesen, um zu überleben. Aber sie bergen auch das Risiko von Komplikationen, die zu potenziell lebensbedrohlichen Infektionen führen können. Solche Komplikationen beginnen oft mit der Bildung von Biofilm im Katheter: Wenn sich Bakterien und Pilze ansammeln und vermehren, werden sie im Laufe der Zeit auch immer resistenter. Sobald diese Erreger in die Blutbahn des Patienten gelangen, können sie eine katheterabhängige Blutstrominfektion („catheter-related bloodstream infection“, kurz CRBSI) verursachen, die schlimmstenfalls tödlich endet. Daher ist es von entscheidender Bedeutung, die Bildung von Biofilm frühzeitig zu verhindern. Wie oben dargestellt belegen klinische Evidenzen, dass Taurolidin genau das tut. Vor diesem Hintergrund kamen die Gründer von TauroPharmauf die Idee, Taurolidin-basierte Locklösungen für zentralvenöse Katheter zu entwickeln.
Heute verfügen wir über eine Reihe von Produkten, die alle Taurolidin als antimikrobiellen Wirkstoff enthalten. Vier dieser Produkte enthalten auch andere Wirkstoffe, um den individuellen Bedürfnissen der verschiedenen Patienten gerecht zu werden: Maßgeschneiderte Lösungen für Katheter-Locks.
| Produkt | Inhaltsstoffe | Empfohlener Anwendungsbereich |
|---|---|---|
 |
|
|
 |
|
|
 |
|
|
 |
|
|
 |
|
|
*Internationale Einheiten
In den letzten 20 Jahren haben zahlreiche Studien die Wirksamkeit von Locklösungen auf Taurolidin-Basis (und speziell von TauroLock™-Produkten) in allen relevanten Anwendungsbereichen bestätigt. Die zunehmende Menge klinischer Nachweise hat wiederum dazu geführt, dass nationale und internationale Leitlinien Taurolidin in ihre Empfehlungen aufnehmen. Alle diese Veröffentlichungen (sowohl Studien als auch Leitlinien) können auf unserer Website heruntergeladen werden.
Taurolidine in der Herzchirurgie
Jüngst hat Taurolidin in einem anderen Zusammenhang für Aufmerksamkeit gesorgt: Die Prävention von CIED-Infektionen. CIEDs (kurz für „cardiac implantable electronic devices", gemeinhin als Herzschrittmacher bekannt) bringen ein ähnliches Dilemma mit sich wie CVADs: Die Patienten sind auf sie angewiesen, um zu überleben, aber können durch sie auch eine potenziell lebensbedrohliche Infektion entwickeln. Dieses Risiko hat sich in den letzten Jahren aus mehreren Gründen verschärft. Einerseits sind die CIED-Verfahren komplexer geworden (aufgrund von Hightech-Geräten). Zum anderen ist der durchschnittliche Patient älter geworden und weist daher mehr Komorbiditäten auf. Eine Übersicht aus dem Jahr 2024 [24] veranschaulicht den alarmierenden Status quo am Beispiel Deutschlands:
Die Studiengruppe analysierte Daten, die von der größten Krankenkasse des Landes aus dem Jahr 2015 bereitgestellt wurden. Aus über 27 Millionen Leistungsempfängern ermittelten sie eine Kohorte von mehr als 60.000 Patienten, die sich in jenem Jahr einem invasiven CIED-Eingriff unterzogen. 2,6 % aller Patienten entwickelten innerhalb von drei Monaten nach dem Eingriff eine CIED-Infektion mit einer Sterblichkeitsrate von bis zu 15 %. In Anbetracht dieser Statistiken ist eine wirksame Prävention von CIED-Infektionen heute wichtiger denn je.
Um dieses Problem zu lösen, hat TauroPharm das Produkt TauroPace™ entwickelt. Genau wie alle TauroLock™-Produkte enthält auch diese Lösung Taurolidin als antimikrobiellen Wirkstoff. Bei CIED-Eingriffen (Einsetzen, Entfernen oder Revision) schützt sie die Patienten nachweislich vor Infektionen. Bisher (Stand 2025) haben zwei Studien die Wirksamkeit von TauroPace™bestätigt.
- Die erste klinische Studie wurde im Jahr 2023 veröffentlicht. Darin wurde berichtet, dass die Verwendung von TauroPace™ bei 654 Eingriffen an 631 Patienten zu 0,00 CIED-Infektionen (innerhalb der dreimonatigen Nachbeobachtungszeit) führte. [25]
- Im Jahr 2024 wurden in einem frühen Bericht des europäischen Registers die Ergebnisse einer klinischen Studie mit 822 CIED-Eingriffen unter Verwendung von TauroPace™vorgestellt. Die CIED-Infektionsrate lag drei Monate nach dem Eingriff bei 0,125 %. [26]
Es ist zu erwarten, dass in absehbarer Zeit weitere Studien veröffentlicht werden – aber die bisher vorliegenden Erkenntnisse lassen kaum Zweifel am Potenzial von Taurolidin in der Herzchirurgie. Wie Prof. Charles J. Love es in einem redaktionellen Kommentar aus dem Jahr 2023 formulierte: „Taurolidin könnte uns einen Schritt näher zur ‚Silberkugel' bringen, die Mikroben abtötet, eine CIED-Infektion verhindert und den Wirt nicht beeinträchtigt." [2]
- Browne 1985. Pharmacological and clinical studies with Taurolin. 1985. Print.
- Love. EP Europace 2023. DOI: 10.1093/europace/euad332
- Neary et al. Ann Surg Oncol 2010. DOI: 10.1245/s10434-009-0867-9
- Singh et al. Science 2023. DOI: 10.1126/science.abn9257
- Shrayer et al. Anticancer Drugs 2003. DOI: 10.1097/00001813-200304000-00007
- Calabresi et al. Cancer Res 2001. PMID: 11559556
- Bedrosian et al. Cytokine 1991. DOI: 10.1016/1043-4666(91)90483-t
- Fontseré et al. Antimicrob Agents Chemother 2014. DOI: 10.1128/AAC.02421-14
- Härtel et al. J Microbiol Immunol Infect 2012. DOI: 10.1016/j.jmii.2012.04.00
- Rittershaus et al. Cell Host Microbe 2013. DOI:10.1016/j.chom.2013.05.012
- Torres-Viera et al. Antimicrob Agents Chemother 2000. DOI: 10.1128/AAC.44.6.1720-1724.2000
- Shah et al. Antimicrob Agents Chemother 2002. DOI: 10.1128/AAC.46.6.1674–1679.2002
- Pjatkowska et al. PLoS ONE 2021. DOI: 10.1371/journal.pone.0258148
- Visek et al. JPEN J Parenter Enteral Nutr 2025 DOI: 10.1002/jpen.2725
- Ocana et al. Präsentation auf dem ESPEN-Kongress 2024.
- Linder et al. 1980. Langenbecks Arch Chir Suppl Chir Forum 1980. Print.
- Aukland et al. in Brücker et al. Urban & Schwarzenberg 1985. Print.
- Reith. Langenbecks Arch Chir 1997. DOI: 10.1007/pl00014637
- Watson et al. J Leukoc Biol 1995. DOI: 10.1002/jlb.58.3.299
- Rosman et al. Eur Surg Res 1996. DOI: 10.1159/000129476
- Amanati et al. J Med Case Rep 2025. DOI: 10.1186/s13256-025-05094-5
- Barrios et al. J Vasc Access 2020. DOI: 10.1177/1129729820937099
- Baldauf et al. Scientific Reports 2024. DOI: 10.1038/s41598-024-82622-1
- Borov et al. EP Europace 2023. DOI: 10.1093/europace/euad306
- Vonthein et al. J Cardiothorac Surg 2024. DOI: 10.1186/s13019-024-03059-1


